Топливные элементы. Устройство, виды, принцип действия топливных элементов.
Топливные элементы
Топливный элемент – это электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне - в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.


Рис. 1. Некоторые топливные элементы
Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные процессы горения, идущие с большими потерями. Они в результате химической реакции преобразовывают водород и кислород в электричество. В результате этого процесса образуется вода и выделяется большое количество теплоты. Топливный элемент очень похож на аккумулятор, который можно зарядить и затем использовать накопленную электрическую энергию. Изобретателем топливного элемента считают Вильяма Р. Грува, который изобрел его еще в 1839 году. В этом топливном элементе в качестве электролита использовался раствор серной кислоты, а в качестве топлива - водород, который соединялся с кислородом в среде окислителя. До недавнего времени топливные элементы использовались только в лабораториях и на космических аппаратах.
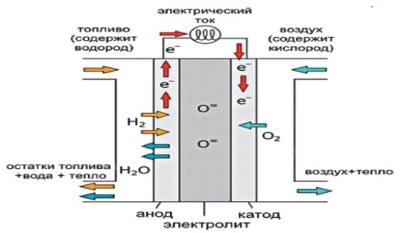
Рис. 2. Устройство топливного элемента
В отличие от других генераторов электроэнергии, таких как двигатели внутреннего сгорания или турбины, работающие на газе, угле, мазуте и пр., топливные элементы не сжигают топливо. Это означает отсутствие шумных роторов высокого давления, громкого шума при выхлопе, вибраций. Топливные элементы вырабатывают электричество путем бесшумной электрохимической реакции. Другой особенностью топливных элементов является то, что они преобразуют химическую энергию топлива напрямую в электричество, теплоту и воду.
Топливные элементы высокоэффективны и не производят большого количества парниковых газов, таких как углекислый газ, метан и оксид азота. Единственным продуктом выброса при работе топливных элементов являются вода в виде пара и небольшое количество углекислого газа, который вообще не выделяется, если в качестве топлива используется чистый водород. Топливные элементы собираются в сборки, а затем в отдельные функциональные модули.
Топливные элементы не имеют движущихся частей (по крайней мере, внутри самого элемента), и поэтому они не подчиняются закону Карно. То есть они будут иметь больший, чем 50%, КПД и особенно эффективны при малых нагрузках. Таким образом, автомобили с топливными элементами могут стать (и уже доказали это) более экономичными, чем обычные автомобили в реальных условиях движения.
Топливный элемент обеспечивает выработку электрического тока постоянного напряжения, который может использоваться для привода в действие электродвигателя, приборов системы освещения и других электрических систем в автомобиле.
Есть несколько типов топливных элементов, различающихся используемыми химическими процессами. Топливные элементы обычно классифицируются по типу используемого в них электролита.
Некоторые типы топливных элементов являются перспективными для применения их в качестве силовых установок электростанций, а другие - для портативных устройств или для привода автомобилей.
1. Щелочные топливные элементы (ЩТЭ)
Щелочной топливный элемент - это один из самых первых разработанных элементов. Щелочные топливные элементы (ЩТЭ) – одна из наиболее изученных технологий, используемая с середины 60-х годов ХХ века агентством НАСА в программах «Аполлон» и «Спейс Шаттл». На борту этих космических кораблей топливные элементы производят электрическую энергию и питьевую воду.
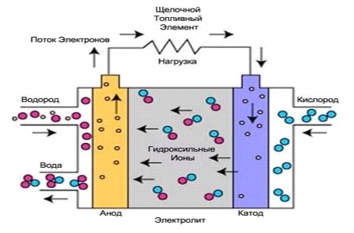
Рис. 3. Процессы в щелочном топливном элементе
Щелочные топливные элементы – одни из самых эффективных элементов, используемых для генерации электричества, эффективность выработки электроэнергии доходит до 70%.
В щелочных топливных элементах используется электролит, то есть водный раствор гидроксида калия, содержащийся в пористой стабилизированной матрице. Концентрация гидроксида калия может меняться в зависимости от рабочей температуры топливного элемента, диапазон которой варьируется от 65°С до 220°С. Носителем заряда в ЩТЭ является гидроксильный ион (ОН-), движущийся от катода к аноду, где он вступает в реакцию с водородом, производя воду и электроны. Вода, полученная на аноде, движется обратно к катоду, снова генерируя там гидроксильные ионы. В результате этого ряда реакций, проходящих в топливном элементе, производится электричество и, как побочный продукт, теплоту:
Реакция на аноде: 2H2 + 4OH- => 4H2O + 4e
Реакция на катоде: O2 + 2H2O + 4e- => 4OH
Общая реакция системы: 2H2 + O2 => 2H2O
Достоинством ЩТЭ является то, что эти топливные элементы - самые дешевые в производстве, поскольку катализатором, который необходим на электродах, может быть любое из веществ, более дешевых, чем те, что используют в качестве катализаторов для других топливных элементов. Кроме того, ЩТЭ работают при относительно низкой температуре и являются одними из самых эффективных.
Одна из характерных особенностей ЩТЭ – высокая чувствительность к CO2, который может содержаться в топливе или воздухе. CO2 вступает в реакцию с электролитом, быстро отравляет его, и сильно снижает эффективность топливного элемента. Поэтому использование ЩТЭ ограничено закрытыми пространствами, такими как космические и подводные аппараты, они работают на чистом водороде и кислороде.
2. Топливные элементы на расплаве карбоната (РКТЭ)
Топливные элементы с расплавленным карбонатным электролитом являются высокотемпературными топливными элементами. Высокая рабочая температура позволяет непосредственно использовать природный газ без топливного процессора и топливного газа с низкой теплотворной способностью топлива производственных процессов и из других источников. Данный процесс разработан в середине 60-х годов ХХ века. С того времени была улучшена технология производства, рабочие показатели и надежность.
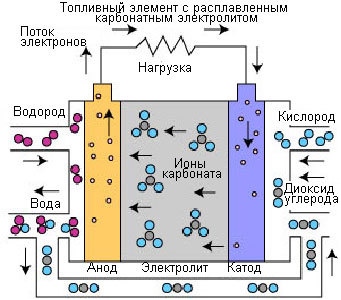
Рис. 4. Процессы в топливном элементе на расплаве карбоната
Работа РКТЭ отличается от других топливных элементов. Данные элементы используют электролит из смеси расплавленных карбонатных солей. В настоящее время применяется два типа смесей: карбонат лития и карбонат калия или карбонат лития и карбонат натрия. Для расплавки карбонатных солей и достижения высокой степени подвижности ионов в электролите, работа топливных элементов с расплавленным карбонатным электролитом происходит при высоких температурах (650°C). КПД варьируется в пределах 60-80%.
При нагреве до температуры 650°C соли становятся проводником для ионов карбоната (CO32-). Эти ионы проходят от катода на анод, где происходит объединение с водородом с образованием воды, диоксида углерода и свободных электронов. Данные электроны направляются по внешней электрической цепи обратно на катод, при этом генерируется электрический ток, а в качестве побочного продукта – теплота.
Реакция на аноде: CO32- + H2 => H2O + CO2 + 2e
Реакция на катоде: CO2 + 1/2O2 + 2e- => CO32-
Общая реакция элемента: H2(g) + 1/2O2(g) + CO2(катод) => H2O(g) + CO2(анод)
Высокие рабочие температуры топливных элементов с расплавленным карбонатным электролитом имеют определенные преимущества. Преимущество - возможность применять стандартные материалы (листовую нержавеющую сталь и никелевый катализатор на электродах). Побочную теплоту можно использовать для получения пара высокого давления. Высокие температуры реакции в электролите также имеют свои преимущества. Применение высоких температур требует большого времени для достижения оптимальных рабочих условий, при этом система медленнее реагирует на изменение расхода энергии. Данные характеристики позволяют использовать установки на топливных элементах с расплавленным карбонатным электролитом в условиях постоянной мощности. Высокие температуры препятствуют повреждению топливного элемента окисью углерода, «отравлению» и пр.
Топливные элементы с расплавленным карбонатным электролитом подходят для использования в больших стационарных установках. Промышленно выпускаются теплоэнергетические установки с выходной электрической мощностью 2,8 МВт. Разрабатываются установки с выходной мощностью до 100 МВт.
3. Топливные элементы на основе фосфорной кислоты (ФКТЭ)
Топливные элементы на основе фосфорной (ортофосфорной) кислоты стали первыми топливными элементами для коммерческого использования. Данный процесс был разработан в середине 60-х годов ХХ, испытания проводились с 70-х годов ХХ века. В итоге были увеличены стабильность и рабочие показатели и снижена стоимость.
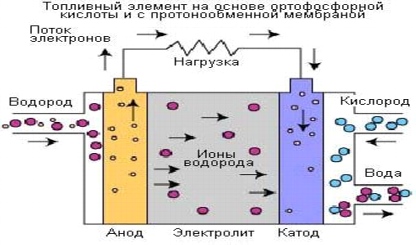
Рис. 5. Процессы в топливном элементе на основе ортофосфорной кислоты
Топливные элементы на основе фосфорной (ортофосфорной) кислоты используют электролит на основе ортофосфорной кислоты (H3PO4) с концентрацией до 100%. Ионная проводимость ортофосфорной кислоты является низкой при низких температурах, поэтому эти топливные элементы используются при температурах до 150-220 °C.
Носителем заряда в топливных элементах данного типа является водород (H+, протон). Схожий процесс происходит в топливных элементах с мембраной обмена протонов (МОПТЭ), в которых водород, подводимый к аноду, разделяется на протоны и электроны. Протоны проходят по электролиту и объединяются с кислородом, получаемым из воздуха, на катоде с образованием воды. Электроны направляются по внешней электрической цепи, при этом генерируется электрический ток. Ниже представлены реакции, в результате которых генерируется электрический ток и тепло.
Реакция на аноде: 2H2 => 4H+ + 4e
Реакция на катоде: O2(g) + 4H+ + 4e- => 2H2O
Общая реакция элемента: 2H2 + O2 => 2H2O
КПД топливных элементов на основе фосфорной (ортофосфорной) кислоты составляет более 40% при генерации электрической энергии. При комбинированном производстве тепловой и электрической энергии, общий КПД составляет около 85%. Помимо этого, учитывая рабочие температуры, побочную теплоту можно быть использовать для нагрева воды и генерации пара атмосферного давления.
Высокая производительность теплоэнергетических установок на топливных элементах на основе фосфорной (ортофосфорной) кислоты при комбинированном производстве тепловой и электрической энергии является одним из преимуществ данного вида топливных элементов. В установках используется окись углерода с концентрацией около 1,5%, что значительно расширяет возможность выбора топлива. Простая конструкция, низкая степень летучести электролита и повышенная стабильность - также преимущества таких топливных элементов.
Промышленно выпускаются теплоэнергетические установки с выходной электрической мощностью до 400 кВт. Установки мощностью 11 МВт прошли соответствующие испытания. Разрабатываются установки с выходной мощностью до 100 МВт.
4. Топливные элементы с мембраной обмена протонов (МОПТЭ)
Топливные элементы с мембраной обмена протонов считаются самым лучшим типом топливных элементов для генерации питания транспортных средств, которое способно заменить бензиновые и дизельные двигатели внутреннего сгорания. Эти топливные элементы впервые использованы НАСА для программы «Джемини». Разработаны и показаны установки на МОПТЭ мощностью от 1Вт до 2 кВт.
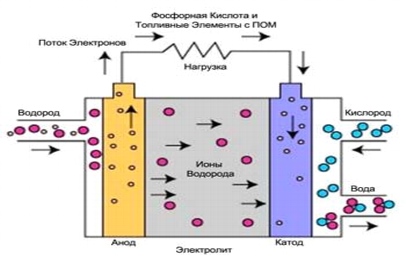
Рис. 6. Процессы в топливном элементе с мембраной обмена протонов
Электролитом в этих топливных элементах является твердая полимерная мембрана (тонкая пластмассовая пленка). При пропитывании водой этот полимер пропускает протоны, но не проводит электроны.
Топливом является водород, а носителем заряда – ион водорода (протон). На аноде молекула водорода разделяется на ион водорода (протон) и электроны. Ионы водорода проходят сквозь электролит к катоду, а электроны перемещаются по внешнему кругу и производят электрическую энергию. Кислород, который берется из воздуха, подается к катоду и соединяется с электронами и ионами водорода, образуя воду. На электродах происходят следующие реакции: Реакция на аноде: 2H2 + 4OH- => 4H2O + 4eРеакция на катоде: O2 + 2H2O + 4e- => 4OHОбщая реакция элемента: 2H2 + O2 => 2H2O По сравнению с другими типами топливных элементов, топливные элементы с мембраной обмена протонов производят больше энергии при заданном объеме или весе топливного элемента. Эта особенность позволяет им быть компактными и легкими. К тому же рабочая температура – менее 100°C, что позволяет быстро начать эксплуатацию. Эти характеристики, а также возможность быстро изменить выход энергии – лишь некоторые, делающие эти топливные элементы первым кандидатом для использования в транспортных средствах.
Другое преимущество в том, что электролитом является твердое, а не жидкое вещество. Удержать газы на катоде и аноде легче с помощью твердого электролита, поэтому такие топливные элементы более дешевы при производстве. При применении твердого электролита нет таких трудностей, как ориентация, и меньше проблем из-за появления коррозии, что повышает долговечность элемента и его компонентов.
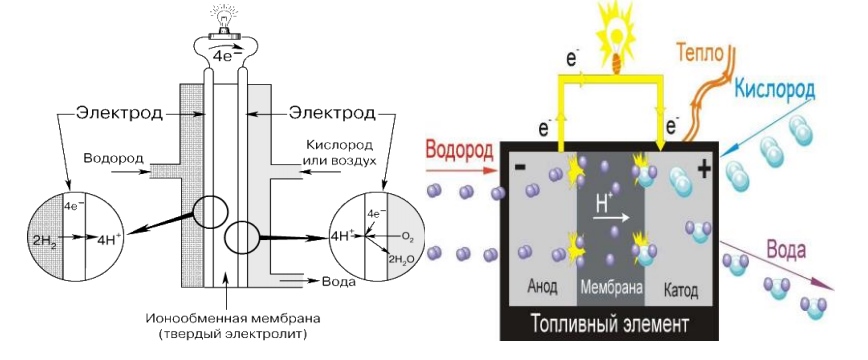
Рис. 7. Принцип работы топливного элемента с твердым электролитом
5. Твердооксидные топливные элементы (ТОТЭ)
Твердооксидные топливные элементы являются топливными элементами с самой высокой рабочей температурой. Рабочая температура может варьироваться от 600°C до 1000°C, что позволяет использовать различные типы топлива без специальной предварительной обработки. Для работы с такими высокими температурами используемый электролит представляет собой тонкий твердый оксид металла на керамической основе, часто сплав иттрия и циркония, который является проводником ионов кислорода (О2-). Технология использования твердооксидных топливных элементов развивается с конца 50-х годов ХХ века и имеет две конфигурации: плоскостную и трубчатую.
Твердый электролит обеспечивает герметичный переход газа от одного электрода к другому, в то время как жидкие электролиты расположены в пористой подложке. Носителем заряда в топливных элементах данного типа является ион кислорода (О2-). На катоде происходит разделение молекул кислорода из воздуха на ион кислорода и четыре электрона. Ионы кислорода проходят по электролиту и объединяются с водородом, при этом образуется четыре свободных электрона. Электроны направляются по внешней электрической цепи, при этом генерируется электрический ток и побочная теплота.
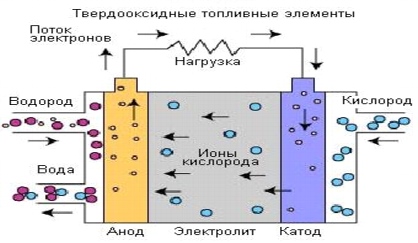
Рис. 8. Процессы в твердооксидном топливном элементе
Реакция на аноде: 2H2 + 2O2- => 2H2O + 4e
Реакция на катоде: O2 + 4e- => 2O2-
Общая реакция элемента: 2H2 + O2 => 2H2O
КПД производства электрической энергии - самый высокий из всех топливных элементов – около 60%. Помимо этого, высокие рабочие температуры позволяют осуществлять комбинированное производство тепловой и электрической энергии для генерации пара высокого давления. Комбинирование высокотемпературного топливного элемента с турбиной позволяет создать гибридный топливный элемент для повышения КПД генерирования электрической энергии до 70%.
Твердооксидные топливные элементы работают при очень высоких температурах (600°C-1000°C), в результате чего требуется значительное время для достижения оптимальных рабочих условий, при этом система медленнее реагирует на изменение расхода энергии. При таких высоких рабочих температурах не требуется преобразователь для восстановления водорода из топлива, что позволяет теплоэнергетической установке работать с относительно нечистым топливом, полученным в результате газификации угля или отработанных газов и т.п. Также данный топливный элемент превосходно подходит для работы с высокой мощностью, включая промышленные и крупные центральные электростанции. Промышленно выпускаются модули с выходной электрической мощностью 100 кВт.
6. Топливные элементы с прямым окислением метанола (ПОМТЭ)
Топливные элементы с прямым окислением метанола успешно применяют в области питания мобильных телефонов, ноутбуков, а также для создания переносных источников электроэнергии, на что и нацелено будущее применение таких элементов.
Устройство топливных элементов с прямым окислением метанола схоже с устройством топливных элементов с мембраной обмена протонов (МОПТЭ), т.е. в качестве электролита используется полимер, а в качестве носителя заряда – ион водорода (протон). Но жидкий метанол (CH3OH) окисляется при наличии воды на аноде с выделением СО2, ионов водорода и электронов, которые направляются по внешней электрической цепи, при этом генерируется электрический ток. Ионы водорода проходят по электролиту и вступает в реакцию с кислородом из воздуха и электронами, поступающих с внешней цепи, с образованием воды на аноде.
Реакция на аноде: CH3OH + H2O => CO2 + 6H+ + 6eРеакция на катоде: 3/2O2 + 6H+ + 6e- => 3H2O Общая реакция элемента: CH3OH + 3/2O2 => CO2 + 2H2O Разработка таких топливных элементов велась с начала90-х годов ХХ века и были увеличены их удельная мощность и КПД до 40%.
Были проведены испытания данных элементов в температурном диапазоне 50-120°C. Из-за низких рабочих температур и отсутствия необходимости использовать преобразователь такие топливные элементы являются лучшим кандидатом для применения как в мобильных телефонах и других товарах широкого потребления, так и в двигателях автомобилей. Их достоинство также - небольшие габариты.
7. Полимерные электролитные топливные элементы (ПЭТЭ)
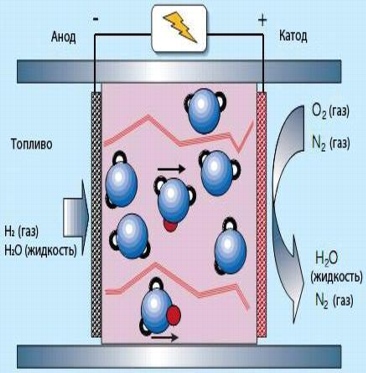
В случае полимерных электролитных топливных элементов полимерная мембрана состоит из полимерных волокон с водными областями, в которых существует проводимость ионов воды H2O+ (протон, красный) присоединяется к молекуле воды. Молекулы воды представляют проблему изза медленного ионного обмена. Поэтому требуется высокая концентрация воды как в топливе, так и на выпускных электродах, что ограничивает рабочую температуру 100°С.
8. Твердокислотные топливные элементы (ТКТЭ)
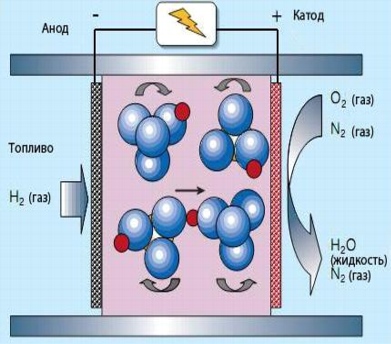
В твердокислотных топливных элементах электролит (CsHSO4) не содержит воды. Рабочая температура поэтому составляет 100-300°С. Вращение оксианионов SO42-позволяет протонам (красный) перемещаться так, как показано на рисунке. Как правило, твердокислотный топливный элемент представляет собой бутерброд, в котором очень тонкий слой твердокислотного компаунда располагается между двумя плотно сжатыми электродами, чтобы обеспечить хороший контакт. При нагреве органический компонент испаряется, выходя через поры в электродах, сохраняя способность многочисленных контактов между топливом (или кислородом на другом конце элементы), электролитом и электродами.
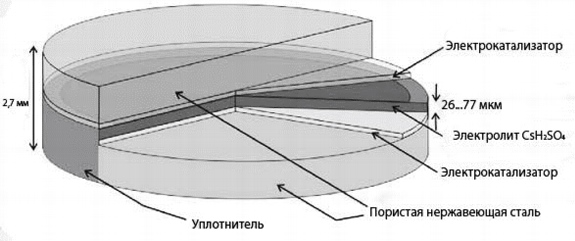
Рис. 9. Устройство топливного элемента
9. Сравнение важнейших характеристик топливных элементов
Тип топливного элемента | Рабочая температура | Эффективность выработки электроэнергии | Тип топлива | Область применения |
РКТЭ | 550-700°С | 50-70% | Большинство видов углеводородного топлива | Средние и большие установки |
ФКТЭ | 100-220°С | 35-40% | Чистый водород | Большие установки |
моптэ | 30-100°С | 35-50% | Чистый водород | Малые установки |
тотэ | 450- 1000°С | 45-70% | Большинство видов углеводородного топлива | Малые, средние и большие установки |
помтэ | 20-90°С | 20-30% | Метанол | Переносные установки |
щтэ | 50-200°С | 40-65% | Чистый водород | Космические исследова ния |
пэтэ | 30-100°С | 35-50% | Чистый водород | Малые установки |
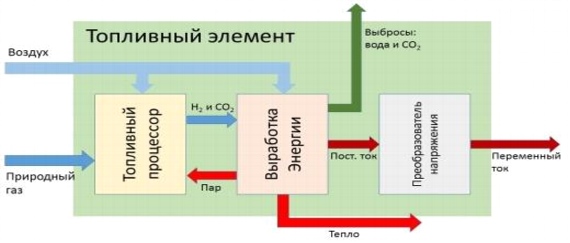
Рис. 10. Принципиальная схема работы топливного элемента
10. Использование топливных элементов в автомобилях
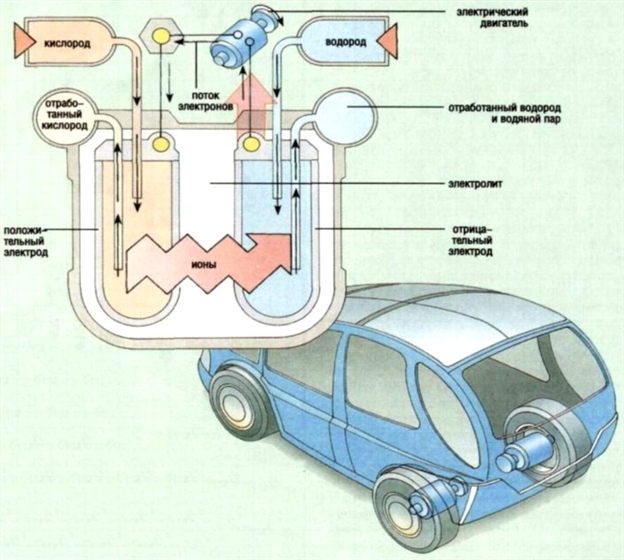
Рис. 11. Принципиальная схема работы топливных элементов
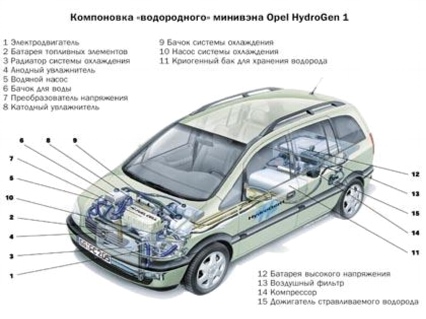
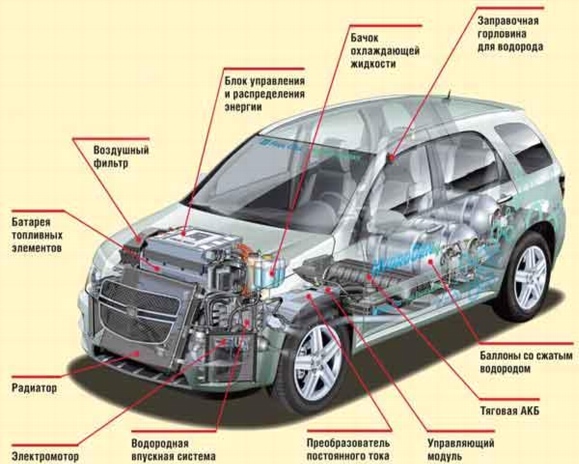
Рис. 12. Компоновка топливных элементов в автомобилях
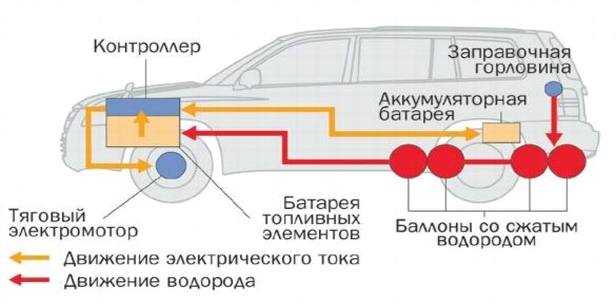
Рис. 13. Компоновка топливных элементов в автомобилях

