Электролиз. Электролизные технологии. Электрохимическая обработка.
1. ЭЛЕКТРОЛИЗНЫЕ ТЕХНОЛОГИИ
1.1. Теория электрохимической обработки
Электрохимия - раздел физической химии, в котором изучаются свойства систем, содержащих подвижные ионы (растворов, расплавов или твердых электролитов), а также явления, возникающие на границе раздела двух фаз (например, металла и раствора электролита) вследствие переноса заряженных частиц (электронов и ионов).
Электролиты - жидкие или твердые вещества, в которых в сколько-нибудь заметных концентрациях присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле - соли, растворы которых проводят электрический ток из-за наличия ионов, образующихся в результате электролитической диссоциации.
Согласно теории электролитической диссоциации, молекулы солей, щелочей, оснований веществ являются полярными, т. е. состоящими из двух ионов, обладающих противоположными и равными по величине зарядами. Силы взаимодействия между ними обеспечивают устойчивую целостность молекулы. При прохождении полярной молекулы между молекулами растворителя (воды), связи между ионами полярной молекулы значительно снижаются. В этих условиях столкновение между молекулами приводит к их распаду на ионы, т. е. к их диссоциации. Таким образом, электролитической диссоциацией называется процесс распада молекул вещества на разноименно заряженные частицы-ионы при его растворении или расплавлении. Количество положительных и отрицательных ионов, образовавшихся в процессе электролитической диссоциации, одинаково. Ионы, имеющие положительный знак, представляют собой атомы или молекулы, потерявшие один или несколько электронов, отрицательные ионы - атомы или молекулы, имеющие один или несколько лишних электронов. Так, при растворении поваренной соли в воде ее молекула распадается на два иона - натрий Na+ и хлор Сl-. Иногда ионами являются не отдельные атомы, а группы атомов, несущие заряд. Например, при растворении в воде сернокислого цинка образуется два иона - положительный Zn2+ и отрицательный SO4-2. Часть молекул растворителя Н20 также может диссоциировать на Н+ и ОН- .
Наряду с процессом диссоциации в электролитах иногда протекает и обратный процесс - воссоединение ионов в отдельные молекулы или молизация. При одновременном протекании этих процессов в растворе устанавливается подвижное равновесие. Если поместить электрод в такой раствор, то в системе «электрод - электролит» устанавливается равновесное состояние.
Как в металле, так и в системе «электрод - электролит» находятся одни и те же ионы. В металле они расположены в узлах кристаллических решеток, а в электролите взаимосвязаны с молекулами растворителя. Для перехода иона из узла кристаллической решетки в электролит нужно затратить энергию, которую называют работой выхода иона из металла. Для выхода же иона из электролита в металл необходимо затратить работу, равную энергии гидратации.
На поверхности электрода, помещенного в электролит, протекает обратимая электрохимическая реакция
Me ↔ Men+ + ne-, (1.1)
где Men+ - ион металла в растворе; n - валентность металла; е - электрон.
В условиях равновесия скорость прямой и обратной реакций по схеме (1.1) одинакова, т. е. скорость окисления атомов Me и восстановления ионов Меn+ (осаждения) соответственно равны.
Прохождение электрического тока через электролит. В растворах электролитов ионы, как и молекулы, движутся хаотически. Если же к опущенным в электролит электродам приложить электрический потенциал, то кроме хаотичного появится и направленное движение ионов. Положительные ионы (катионы) направляются к катоду, а отрицательные (анионы) - к аноду. Дойдя до соответствующих электродов, ионы отдают им свои заряды и, став обычными атомами или молекулами, выделяются на электродах или вступают в химические реакции с материалом электрода. Электрический ток в электролитах - это направленное движение ионов в электрическом поле. В отличие от металлов и полупроводников прохождение электрического тока через электролит обусловлено переносом массы вещества.
Количество вещества g, выделившееся на электроде при прохождении электрического тока через раствор электролита, определяется законом Фарадея
g = αIτ, (1.2)
где α — электрохимический эквивалент, г/Кл; I — ток, А; τ - время прохождения тока, с.
Электрохимический эквивалент (а) - количество вещества, выделившееся из электролита при прохождении одного кулона электричества. Численно он равен отношению химического эквивалента вещества к числу Фарадея. Число Фарадея (Fв) — количество электричества, требующееся для выделения одного грамм-эквивалента вещества [Fв = 96485 Кл/(г*экв)].
Электрические процессы в электролитах подчиняются закону Ома. Для доказательства этого рассмотрим движение ионов в электролите под действием электрического поля. Ион, движущийся под действием поля в электролите, непрерывно сталкивается с молекулами жидкости, передавая им полученную в электрическом поле энергию, что выражается в нагревании электролита.
1.2. Электролиз растворов и расплавов
Процессы окисления или восстановления на электродах при прохождении через электролит тока, сопровождающиеся приобретением или потерей частицами вещества электронов, называются электролизом.
На производстве электролиз применяется чаще всего для анодного растворения металла и его катодного осаждения из растворов и расплавов.
Металлы с нормальным потенциалом больше 1 по отношению к потенциалу нормального водородного электрода получают электролизом из растворов (медь, цинк). Металлы с нормальным потенциалом меньше 1 получают электролизом из расплавов солей этих металлов (литий, калий, алюминий, магний).
Электролиз алюминия.
При нормальном потенциале выделения металла меньше 1 В получить его на катоде путем электролиза раствора невозможно: на катоде будут выделяться в основном водород, на аноде — примеси электролита. Так как нормальный потенциал алюминия —1,67 В, то его получение возможно электролизом расплавленных солей. В этом процессе электролитом служит раствор оксида алюминия Аl203 в расплавленном криолите (Na3AlF6).
Ввиду агрессивности фторидных расплавов электролиз алюминия ведут с расходуемыми угольными электродами, а поверхности ванн внутри футеруют угольными плитами и блоками.
Алюминиевые электролизеры классифицируют по ряду признаков:
1) по силе тока и мощности: 40-50 кА - малой мощности; 50-80 кА - средней мощности; 100-160 кА - большой мощности; 200-250 кА - сверхбольшой мощности;
2) по варианту подвода тока: боковой - электролизеры малой и средней мощности; верхний - электролизеры большой мощности;
3) по конструкции анода: самоспекающийся за счет теплоты ванны и обожженный. Обожженные аноды рассчитаны только на верхний подвод тока. Самоспекающиеся аноды размещают по одному на ванну. Кожух электролизера сварен из стальных листов, может быть с днищем и без него. Ванну снизу для теплоизоляции заполняют шамотной кладкой. На нее укладывают подовые катодные блоки, к которым крепят токопроводы. С боков ванны покрывают асбестовыми листами, теплоизолируют глиноземной засыпкой и футеруют угольными плитами. Швы плит герметизируют углеродистой массой.
Рабочие размеры анода зависят от мощности ванны и допустимой плотности тока, для ванн средней мощности - 0,80-0,95 А/см2, для мощных - 0,65-0,7 А/см2. Обожженные аноды работают при плотностях тока 0,75-1,0 А/см2.
Главным достоинством самоспекающихся электродов является экономия средств на прессование и обжиг электродов. Их недостатками являются: выделение вредных газов из каждой ванны; высокое сопротивление; выкрашивание, что заставляет снимать с электролита угольную крошку.
Анод подвешивают на подвижной раме и автоматически перемещают по металлоконструкциям печи в функции потери напряжения в электролите.
Рабочий ток к ванне подводится с двух сторон по пакетам алюминиевых шин. От шин к штырям подвод тока осуществляется по гибким медным токоподводам, а в массу анода ток вводится по стальным штырям. В случае верхней подводки штырь и шина соединяются колодкой с пружинным зажимом для прочности контакта.
Алюминиевые электролизеры объединяют в серию из 160-170 шт., причем 4-5 из них резервные. Ванны серии, как правило, устанавливают в двух корпусах и в два ряда. Полы электролизного цеха делают электроизолированными.
Ток через ванну при электролизе расплавов доходит до 100 кА и более, поэтому ванны включают в серии последовательно без предварительного объединения их в блоки. Более подробные данные по электролизу алюминия можно найти в специальной литературе.
1.3. Электрохимическая обработка изделий
Способы обработки материалов, которые применяются для удаления материала с обрабатываемых поверхностей, с использованием электрической энергии, вводимой непосредственно в зону обработки, называются электрохимическими (ЭХО).
В новых электрохимических методах используется главным образом процесс анодного растворения, т. е. переход металла детали, помещаемой в электролизер в качестве анода, из металлического в ионное состояние:
гравирование и маркирование по металлам. На деталь, которая является анодом, наносят слой воска, лака или другого изолирующего вещества. Анодное растворение протекает в тех местах, где металл не изолирован;
изготовление сеток (аналогично электрохимическому гравированию). Сетку-рисунок наносят изолирующим составом на поверхность детали-анода: она предохраняет металл от растворения. Обнаженные участки внутри лаковой сетки растворяются;
изготовление листового металла малой толщины путем анодного растворения основано на этом же принципе.
Нанесение металлопокрытий и анодирование.
Процесс нанесения металлопокрытий на поверхность металлических изделий методом электролиза называется гальванотехникой. Гальванотехника подразделяется на гальваностегию и гальванопластику.
Гальваностегия - электрохимическое нанесение металлов на металлические изделия с целью улучшения их физико-механических свойств, антикоррозионной защиты и декоративных качеств.
Гальванопластика - электрохимический процесс нанесения металлов на шаблоны, используемые при изготовлении штампов различных изделий (музыкальные пластинки-диски, типографские клише, скульптуры и т. д.). Перед нанесением металлов шаблоны (из воска, гипса, дерева и Т. П.) покрывают слоем графита с целью придания их поверхностям электропроводных свойств.
Анодирование - процесс нанесения оксидных антикоррозионных покрытий на поверхности металлических изделий путем их анодной обработки в специальных растворах. Главным образом оно применяется для защиты от коррозии изделий из алюминия, магния и их сплавов. При анодировании на поверхности детали образуется двойной оксидный слой: верхний - толстый пористый слой и нижний - тонкий плотный. Алюминиевая оксидная пленка характеризуется хорошими антикоррозионными и электроизолирующими свойствами.
Для получения хорошей адгезии металлопокрытия с основным металлом поверхность детали тщательно очищают различными методами: механическим (шлифование, полирование), электрохимическим (обезжиривание, травление), а также возможна ультразвуковая обработка.
Гальванические ванны для металлопокрытий выполняют из стали, изнутри футеруют винипластом. По бортам ванн на изоляторах устанавливают анодные и катодные штанги, присоединяемые к выпрямителю. На катодные шины подвешивают обрабатываемые детали, а на анодные - пластины из металла, которым покрывается изделие. Находящийся в ванне электролит подогревается.
Рабочие ванны включают в цепь последовательно, если для процесса требуется одинаковый ток. При работе ванн с переменной нагрузкой каждая из них подключается к выпрямителю параллельно.
1.4. Электроснабжение электрохимических технологий
Способ электрохимической обработки основан на анодном растворении металла, которое может идти на постоянном, импульсном, пульсирующем или асимметричном переменном токе. Источники питания (ИП) - полупроводниковые выпрямители - преобразуют переменный синусоидальный ток в необходимую форму для электрохимической обработки и должны соответствовать ряду требований: обеспечивать точность и стабильность обработки; исключать разрушение электродов при коротких замыканиях, осуществлять ступенчатую и плавную регулировку тока и напряжения и их стабилизацию; быть экономичными, удобными в эксплуатации и малогабаритными. Технологические параметры ИП определяются их внешними характеристиками. Они могут быть жесткими, естественными (слабопадающими) и крутопадающими [33].
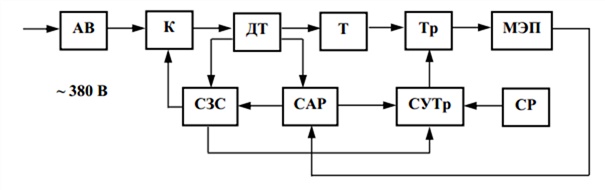
Рис. 1.1. Структурная схема источника питания установок электрохимической обработки
Структурная схема ИП включает понижающий трансформатор, выпрямитель, цепь стабилизации условий обработки изделия, регулирования параметров процесса, устройства защиты источника питания и станка при нарушении хода обработки. В статических ИП регулирующими элементами являются тиристоры. Они имеют малые массу и габариты, меньшую инерционность, более высокий КПД и быстродействующую систему защиты оборудования от коротких замыканий (рис. 1.1).
При подаче напряжения от сети после срабатывания автоматического выключателя АВ и силового контактора К через датчики тока ДТ напряжение подается на силовой трансформатор Т. Пониженное напряжение поступает на блок тиристоров Тр, работой которых управляет система управления тиристорами СУТр. Изменяя подаваемые СУТр сигналы, можно получить различную форму выпрямленного напряжения и тока. Система реверсирования СР обусловливает смену полярности ИП.
При сбое рабочего режима установки, с датчиков тока ДТ на систему автоматического регулирования САР подаются сигналы, по которым СУТр запирает тиристоры. Команда на отключение силового контактора К подается системой защиты и сигнализации СЗС, в результате ИП отключается от сети.
Предусматривается отключение в источнике питания и от сети, и от силового трансформатора, что обеспечивает нормальную работу электрической части оборудования. Система автоматического регулирования стабилизирует напряжение или ток в межэлектродном промежутке. Исполнительным органом САР является магнитный усилитель, обмотки управления которого питаются от датчиков тока ДТ, межэлектродного промежутка МЭП и опорного напряжения. Схему управления тиристорами СУТр подключают к выходу магнитного усилителя.
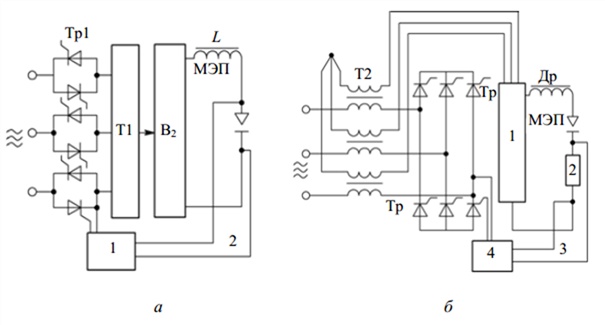
Рис. 1.2. Принципиальные схемы тиристорного источника питания установок электрохимической обработки
На рис. 1.2 представлены принципиальные схемы тиристорных ИП установок электрохимической обработки на токи выше 600 А. В схеме рис. 1.2, а используются тиристоры Тр1 на первичной стороне силового трансформатора Т1 с неуправляемым выпрямителем В2 на его вторичной стороне. Тиристоры включены в рассечку фаз сети (рис. 1.2, а) или по трехфазной мостовой схеме в разрыв нейтрали звезды на первичной стороне трансформатора (рис. 1.2, б).
С целью получения жесткой внешней характеристики ИП блок 4 управляет тиристорами по сигналам обратной связи 3 по выходному напряжению с МЭП (рис. 1.2, а). Для создания крутопадающей характеристики (рис. 1.2, б) тиристоры управляются сигналом обратной связи в функции тока нагрузки. Сигнал поступает в блок управления 4 с резистора 2. Естественная внешняя характеристика выпрямителя получается поддержанием заданного угла ее наклона за счет обратных связей по току и напряжению. Дроссели Др включают для уменьшения пульсаций рабочего тока при тиристорном регулировании.
Электрохимия проникла во все отрасли машиностроительной индустрии и имеет важное значение для защиты стальных изделий от коррозии. Электролиз является основой для получения алюминия, рафинирования меди и других цветных металлов. Электрохимическая обработка изделий позволяет осуществлять целый ряд процессов с использованием электрического тока: гравирование и маркировку по металлам, гальваностегию и гальванопластику, анодирование и др. Данная технология обработки деталей позволяет осуществлять процесс осаждения или растворения металла, не оказывая на него теплового воздействия.
В практике нередко возникает необходимость обработки деталей с высокими физико-механическими свойствами, имеющими сложную форму или криволинейные отверстия. В этом случае электрохимия оказалась бессильной. На помощь производственникам пришла технология электроэрозионной обработки металлических изделий.
| Лазеры. Технологические основы лазерной обработки. |
| Установки электронно-лучевого нагрева. |
| Плазменные технологии. Плазменная резка и сварка. Плазменное нанесение покрытий и плавление. Плазмотрон. |

