
Абсорбционные и адсорбционные аппараты.
1. Абсорбция. Конструкции, принцип действия абсорбционных аппаратов
Для получения целевых продуктов, выделения компонентов из газовых смесей, удаления посторонних примесей из газовых и жидких смесей, осушки и в других случаях применяют сорбционные установки. Сорбция — физико-химический процесс, в результате которого происходит поглощение каким-либо телом газов, паров или растворенных веществ из окружающей среды. Понятие сорбции включает как абсорбцию, так и адсорбцию.
Абсорбция — поглощение газа в объеме, а также избирательное поглощение одного или нескольких компонентов газовой смеси жидким поглотителем (абсорбентом). Поглощение газа может происходить либо в результате его растворения в абсорбенте, либо в результате его химического взаимодействия с абсорбентом. В первом случае процесс называют физической абсорбцией, а во втором — хемосорбцией. Возможно также сочетание обоих механизмов процесса.
Физическая абсорбция в большинстве случаев обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора — десорбция. Сочетание абсорбции с десорбцией позволяет многократно применять поглотитель и выделять поглощенный компонент в чистом виде.
Абсорбентами служат однородные жидкости или растворы активного компонента в жидком растворителе. Во всех случаях к абсорбентам предъявляют ряд требований, среди которых наиболее существенными являются высокая абсорбционая способность, селективность, низкое давление паров, химическая инертность по отношению к распространенным конструкционным материалам (при физической абсорбции — также к компонентам газовых смесей), нетоксичность, огне- и взрывобезопасность, доступность и невысокая стоимость.
С технологической точки зрения лучшим является тот абсорбент, расход которого для проведения заданного процесса меньше, т. е. в котором растворимость поглощаемого вещества выше. Поэтому абсорбенты выбирают в основном по данным о растворимости в них поглощаемых веществ.
Процесс физической абсорбции газа сопровождается выделением теплоты и, следовательно, повышением температуры абсорбента и контактирующей с ним газовой смеси. При значительном росте температуры возможно резкое понижение растворимости газа, поэтому для поддержания требуемой производительности абсорбера приходится в ряде случаев прибегать к его охлаждению внутренними или внешними охлаждающими элементами.
В абсорбционных процессах участвуют две фазы — газовая и жидкая. Газовая фаза состоит из непоглощаемого газа-носителя и одного или нескольких абсорбируемых компонентов. Жидкая фаза представляет собой раствор абсорбируемого (целевого) компонента в жидком поглотителе. При физической абсорбции газ-носитель и жидкий поглотитель (абсорбент) инертны взаимно и по отношению к переходящему компоненту.
Равновесие в процессах абсорбции определяет состояние, которое устанавливается при продолжительном соприкосновении фаз и зависит от состава фаз, температуры, давления и термодинамических свойств компонента и абсорбента.
В технике используют следующие принципиальные схемы абсорбционных процессов: прямоточные, противоточные, одноступенчатые с рециркуляцией и многоступенчатые с рециркуляцией.
Прямоточная схема взаимодействия веществ в процессе абсорбции показана на рис. 1, а. В этом случае потоки газа и абсорбента движутся параллельно друг другу, при этом газ с большей концентрацией распределяемого вещества приводится в контакт с жидкостью, имеющей меньшую концентрацию распределяемого вещества, и наоборот. Противоточная схема абсорбции показана на рис. 1, б. По этой схеме в одном конце аппарата приводят в контакт свежий газ и жидкость, имеющие большие концентрации распределенного вещества, а в противоположном — меньшие. В схемах с рециркуляцией предусмотрен многократный возврат в аппарат жидкости или газа. Схема с рециркуляцией жидкости показана на рис. 1, в. Газ проходит через аппарат снизу вверх, и концентрация распределяемого вещества в нем изменяется от Yн до Yк Поглощающая жидкость подводится к верхней части аппарата при концентрации распределяемого вещества Yн затем смешивается с выходящей из аппарата жидкостью, в результате чего ее концентрация повышается до Xс. Рабочая линия представлена на диаграмме отрезком прямой: крайние точки его имеют координаты Yн, Хк и Xк, Хс соответственно. Значение Хс определяют из уравнения материального баланса.
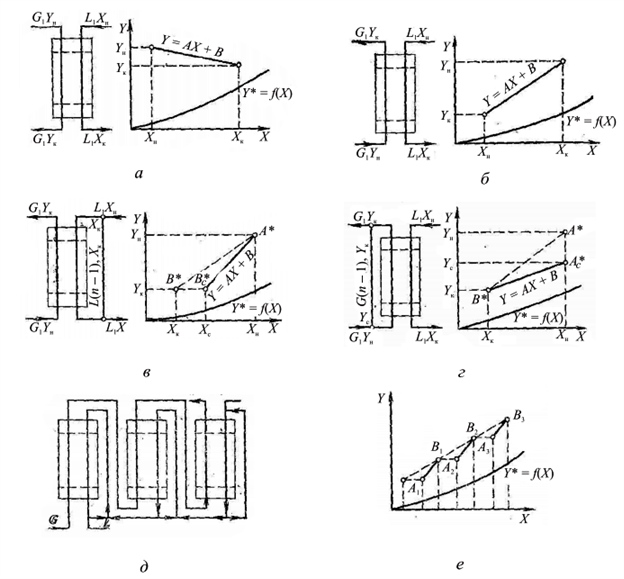
Рис. 1. Принципиальные схемы абсорбции: а — прямоточная; б — противоточная; в — с рециркуляцией жидкости; г — с рециркуляцией газа; д — многоступенчатая с рециркуляцией жидкости; е — доля компонента, используемая для рециркуляции
Схема абсорбции с рециркуляцией газа приведена на рис. 1, г. Материальные соотношения здесь аналогичны предыдущим, а положение рабочей линии определяют точки Ас*(Yс, Хк) и B*(Yк, Хн). Ординату Yc находят из уравнения материального баланса. Одноступенчатые схемы с рециркуляцией могут быть как прямоточными, так и противоточными.
Многоступенчатые схемы с рециркуляцией могут быть прямоточными и противоточными, с рециркуляцией газа и жидкости. На рис. 1, д показана многоступенчатая противоточная схема с рециркуляцией жидкости в каждой ступени. На диаграмму рабочие линии наносят отдельно для каждой ступени, как и в случае нескольких отдельных ступенчатых аппаратов. В рассматриваемом случае рабочую линию составляют отрезки А1В1, А2В2 и А3В3.
Анализ описанных процессов позволяет сделать вывод, что одноступенчатые схемы с рециркуляцией абсорбента или газа по сравнению со схемами без рециркуляции имеют следующие отличия: при одном и том же расходе свежего абсорбента количество жидкости, проходящей через аппарат, значительно больше; результатом такого режима являются повышение коэффициента массопередачи и снижение движущей силы процесса. При определенном соотношении между диффузионными сопротивлениями в жидкой и газовой фазах такая схема может способствовать уменьшению габаритов аппарата. Очевидно, что рециркуляция жидкости целесообразна в том случае, если основное сопротивление массопередаче составляет переход вещества от поверхности раздела фаз в жидкость, а рециркуляция газа — когда основным сопротивлением процесса является переход вещества из газовой фазы к поверхности раздела фаз.
Многоступенчатые схемы с рециркуляцией обладают всеми преимуществами одноступенчатых схем и вместе с тем обеспечивают большую движущую силу процесса. Поэтому чаще выбирают варианты схем с многоступенчатой рециркуляцией.
Необходимо отметить, что процессы абсорбции характеризуются тем, что из-за малой относительной летучести абсорбента перенос вещества происходит преимущественно в одном направлении — из газовой фазы в жидкую. Переход поглощаемого вещества из газового состояния в конденсированное (жидкое) сопровождается уменьшением энергии в нем. Таким образом, в результате абсорбции происходит выделение теплоты, количество которой равно произведению количества поглощенного вещества на теплоту его конденсации. Связанное с этим повышение температуры взаимодействующих фаз, которое определяют с помощью уравнения теплового баланса, уменьшает равновесное содержание поглощаемого вещества в жидкой фазе, т. е. ухудшает разделение. Поэтому при необходимости целесообразен отвод теплоты абсорбции.
Конструктивно абсорбционные аппараты выполняют аналогично теплообменным, ректификационным, выпарным и сушильным аппаратам. По принципу действия абсорбционные аппараты можно разделить на поверхностные, барботажные и распылительные.
2. Адсорбция. Конструкции, принцип действия адсорбционных аппаратов
Адсорбция — процесс поглощения газов (паров) или жидкостей поверхностью твердых тел (адсорбентов). Явление адсорбции связано с наличием сил притяжения между молекулами адсорбента и поглощаемого вещества. По сравнению с другими массообменными процессами адсорбция наиболее эффективна в случае малого содержания извлекаемых компонентов в исходной смеси.
Различают два основных вида адсорбции: физическую и химическую (или хемосорбцию). Физическая адсорбция вызывается силами взаимодействия молекул поглощаемого вещества с адсорбентом (дисперсионными или ван-дер-ваальсовскими). Однако молекулы, соприкасаясь с поверхностью адсорбента, насыщают его поверхность, что ухудшает процесс адсорбции. Химическая адсорбция характеризуется химическим взаимодействием между средой и адсорбентом, что может образовывать новые химические соединения на поверхности адсорбента. Оба вида адсорбции экзотермичны.
Переход вещества из газовой и жидкой фаз в адсорбированное состояние связан с потерей одной степени свободы, т. е. сопровождается уменьшением энтропии и энтальпии системы, следовательно, выделением теплоты. При этом различают дифференциальную и интегральную теплоты адсорбции; первая выражает количество выделяющейся теплоты при поглощении очень малого количества вещества (2 г/100 г адсорбента), вторая — при поглощении до полного насыщения адсорбента. Повышение температуры в каждом процессе адсорбции зависит от теплоты адсорбции и массовой скорости газового (парового) потока, от температуропроводности этого потока и адсорбента, количества адсорбированного вещества и его концентрации. Так как адсорбционная способность адсорбента снижается с ростом температуры, экзотермичность процесса должна учитываться в инженерных расчетах. При больших тепловыделениях прибегают к охлаждению слоя адсорбента.
Процессы адсорбции отличаются избирательностью и обратимостью, позволяя поглощать (адсорбировать) из газовых (паровых) смесей и растворов один или несколько компонентов, а затем в других условиях выделять (десорбировать) их из твердой фазы. При этом избирательность зависит от природы адсорбента и адсорбируемых веществ, а предельное удельное количество поглощаемого вещества зависит еще от его концентрации в исходной смеси и температуры, а в случае газов — также от давления.
Адсорбенты — пористые тела с сильно развитой поверхностью пор. Удельная поверхность пор может достигать 1000 м2/г. Адсорбенты применяют в виде таблеток или шариков размером от 2 до 6 мм, а также порошков с размером частиц от 20 до 50 мкм. В качестве адсорбентов используют активированный уголь, силикагель, алюмосиликаты, цеолиты (молекулярные сита) и др. Важной характеристикой адсорбентов является их активность, под которой понимают массу адсорбированного вещества на единицу массы адсорбента в условиях равновесия. Активность адсорбента равна:
a = M/G, (8.1)
где М — масса поглощенных компонентов; G — масса адсорбента.
Адсорбенты характеризуются также временем защитного действия, под которым понимают время, в течение которого концентрация поглощаемых веществ на выходе из слоя адсорбента не изменяется. При большем времени работы адсорбента происходит проскок поглощаемых компонентов, связанный с исчерпанием активности адсорбента. В этом случае необходима регенерация или замена адсорбента.
В связи с разнообразием адсорбентов и адсорбируемых веществ единая теория адсорбции пока не разработана. Закономерности процессов адсорбции, в которых определяющую роль играют ван-дер-ваальсовские силы притяжения, можно удовлетворительно описать так называемой потенциальной теорией адсорбции. Согласно этой теории на поверхности адсорбента образуется полимолекулярный адсорбционный слой, энергетическое состояние молекул в котором определяет и значением адсорбционного потенциала, являющегося функцией расстояния от поверхности, и не зависит от температуры. Наибольшее знание адсорбционный потенциал имеет на поверхности адсорбента. Потенциальная теория применима к процессам адсорбции на адсорбентах, размеры пор которых соизмеримы с размерами поглощаемых молекул. В таких случаях происходит не послойное, а объемное заполнение пор.
Для описания процесса мономолекулярной адсорбции наибольшее применение получила теория Лангмюра, согласно которой за счет некомпенсированных сил у поверхностного атома или молекулы адсорбента адсорбированная молекула удерживается некоторое время не поверхности. Адсорбция происходит в особых точках поверхности — центрах адсорбции. Материальные потоки, участвующие в процессах адсорбции и десорбции, содержат переносимые и «инертные» компоненты. Под первыми понимаются вещества, переходящие из одной фазы в другую, а под вторыми — те которые в таком переносе не участвуют. В твердой фазе «инертным» компонентом является адсорбент.
Скорость процесса адсорбции зависит от условий транспорта адсорбируемого вещества к поверхности адсорбента (внешний перенос), а также от переноса адсорбируемого вещества внутрь зерен адсорбента (внутренний перенос). Скорость внешнего переноса определяется гидродинамической обстановкой процесса, а внутреннего — структурой адсорбента и физико-химическими свойствами системы.
Процессы адсорбции проводятся в основном следующими способами:
1) с неподвижным слоем адсорбента;
2) с движущимся слоем адсорбента;
3) с псевдоожиженным слоем адсорбента.
Принципиальные схемы адсорбционных процессов показаны на рис. 2.
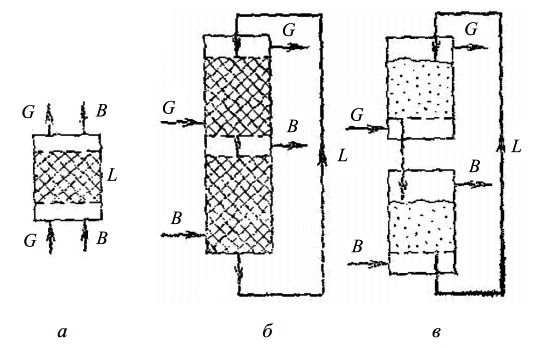
Рис. 2. Принципиальные схемы адсорбции: а — с неподвижным слоем адсорбента; б — с движущимся слоем адсорбента; в — с псевдоожиженным слоем адсорбента
При применении зернистого адсорбента используют схемы с неподвижным (рис. 2, а) и с движущимся (рис. 2, б) адсорбентами. В первом случае процесс проводится периодически. Вначале через адсорбент L пропускают парогазовую смесь G и насыщают его поглощаемым веществом; после этого пропускают вытесняющее вещество В или нагревают адсорбент, осуществляя таким образом десорбцию (регенерацию адсорбента).
Во втором случае адсорбент L циркулирует в замкнутой системе: его насыщение происходит в верхней — адсорбционной — зоне аппарата, а регенерация — в нижней — десорбционной. При применении пылевидного адсорбента используют схему (рис. 8.2, в) с рециркулирующим псевдоожиженным адсорбентом.
| Дистилляционные и ректификационные установки. |
| Сушильные установки. Виды, устройство сушильных установок. |
| Выпарные установки. Виды, устройство, принцип действия выпарных установок. |
